ترکیب یونی: تفاوت میان نسخهها
| [نسخهٔ بررسینشده] | [نسخهٔ بررسینشده] |
قلی زادگان (بحث | مشارکتها) ←واکنشهای جابجایی: اصلاح ارقام |
اصلاح یادکرد |
||
| خط ۱۷۱: | خط ۱۷۱: | ||
اسیدهایی مانند [[کلرو اسید|کلر{{قرمز|و}} اسید]] (HClO<sub>۲</sub>) که به «{{قرمز|و}}» ختم میشوند، به [[کلریت|کلر{{قرمز|یت}}]] (<sup>−</sup>ClO<sub>۲</sub>) و اسیدهایی مانند [[کلریک اسید|کلر{{سبز|یک}} اسید]] (HClO<sub>۳</sub>) که به «{{سبز|یک}}» ختم میشوند، به [[کلرات|کلر{{سبز|ات}}]] (<sup>−</sup>ClO<sub>۳</sub>) تبدیل میشوند.{{Efn|در زبان انگلیسی {{قرمز|ous}} به {{قرمز|ite}} و {{آبی|ic}} به {{آبی|ate}} تبدیل میشود.}}<ref>{{پک|Connelly|2005|ک=Nomenclature of Inorganic Chemistry: IUPAC|ص=254,251}}</ref> |
اسیدهایی مانند [[کلرو اسید|کلر{{قرمز|و}} اسید]] (HClO<sub>۲</sub>) که به «{{قرمز|و}}» ختم میشوند، به [[کلریت|کلر{{قرمز|یت}}]] (<sup>−</sup>ClO<sub>۲</sub>) و اسیدهایی مانند [[کلریک اسید|کلر{{سبز|یک}} اسید]] (HClO<sub>۳</sub>) که به «{{سبز|یک}}» ختم میشوند، به [[کلرات|کلر{{سبز|ات}}]] (<sup>−</sup>ClO<sub>۳</sub>) تبدیل میشوند.{{Efn|در زبان انگلیسی {{قرمز|ous}} به {{قرمز|ite}} و {{آبی|ic}} به {{آبی|ate}} تبدیل میشود.}}<ref>{{پک|Connelly|2005|ک=Nomenclature of Inorganic Chemistry: IUPAC|ص=254,251}}</ref> |
||
در جدول زیر فهرستی از آنیونها و کاتیونهای چند اتمی پرکاربرد و ریز مشخصات آنها ذکر شدهاست:<ref>{{پک|Silberberg|2012|ک=Principles of General Chemistry|ص=56}}</ref><ref>{{پک |
در جدول زیر فهرستی از آنیونها و کاتیونهای چند اتمی پرکاربرد و ریز مشخصات آنها ذکر شدهاست:<ref>{{پک|Silberberg|2012|ک=Principles of General Chemistry|ص=56}}</ref><ref dir="ltr">{{پک|Ebbing|Gammon|2015|ف=General Chemistry|ص=55}}</ref><ref>{{پک|Norman|2020|ف=Chemical compound|زبان=en}}</ref><ref>{{پک/بن|2020|ف=Guanidinium|زبان=en}}</ref><ref>{{پک/بن|2020|ف=Fluoronium|زبان=en}}</ref><ref>{{پک/بن|2020|ف=Pyrylium|زبان=en}}</ref> |
||
{{چپچین}} |
{{چپچین}} |
||
نسخهٔ ۱۵ ژانویهٔ ۲۰۲۱، ساعت ۲۰:۴۷

ترکیبهای یونی دستهای از ترکیبهای شیمیایی هستند که یونهای مثبت و منفی، ذرههای سازنده آنها میباشند. در این ترکیبها هیچ واحد مولکولی مشخصی وجود ندارد. شکل متداول این ترکیبات از یک فلز به عنوان کاتیون و یک نافلز به عنوان آنیون تشکیل میشود. فلزها تمایل به از دست دادن الکترون و تبدیل شدن به یون مثبت و نافلزها تمایل به گرفتن الکترونها و تمایل به تبدیل شدن به یون منفی را دارند. ترکیبات یونی بهطور طبیعی در سنگهای معدنی و به صورت محلول در آب دریاها و اقیانوسها یافت میشوند ولی در هواکره وجود ندارند. نخستین توضیحات علمی در مورد این ترکیبها به دانشمند انگلیسی مایکل فارادی بر میگردد که نام «یون» به معنی «رونده» یا «متحرک» را بر روی اجزای سازنده این ترکیبات قرار داد. نخستین توصیف علمی از ساختار بلوری این ترکیبات توسط ویلیام هنری و ویلیام لورنس براگ در سال ۱۹۱۳ انجام گرفت.
ترکیبات یونی بهوسیله پیوند بسیار قوی یونی تشکیل میشوند؛ در نتیجه، از دمای ذوب و جوش بالایی برخوردارند و عمدتاً در دمای اتاق به صورت جامد هستند. در حالت جامد میتوانند شکل بلورین منظم داشته باشند که از قواعد موجود برای توصیف ساختارهای بلوری در علم بلورشناسی پیروی میکنند. در حالت محلول در حلالهای قطبی، به یونهای مثبت و منفی تفکیک و توسط مولکول حلال، حلالپوشیده میشوند. این مواد به دلیل این که از یک شبکه بلورین یکپارچه تشکیل شدهاند، فاقد مولکولاند؛ در نتیجه سادهترین نسبت کاتیونها به آنیونها که به آن سلول واحد گفته میشوند، به عنوان فرمول شیمیایی آنها کاربرد دارد. سختی، شکنندگی، نارسانایی الکتریکی در حالت جامد، رسانایی الکتریکی در حال مذاب و محلول و تنوع رنگی بالا از دیگر ویژگیهای این ترکیبات است.
این ترکیبات از دیرباز برای بشر شناخته شده بودند؛ از جمله نمک طعام که به عنوان طعمدهنده در غذاها کاربرد دارد. اسامی متعددی بر روی برخی از آنها گذاشته شدهاست اما روش نظاممند و یکپارچه در نام گذاری این مواد توسط اتحادیهٔ بینالمللی شیمی محض و کاربردی (آیوپاک) تعیین شدهاست و امروزه از این روش برای نامگذاری این ترکیبات استفاده میشود. ترکیبات یونی در بدن موجودات زنده از جمله انسان به فراوانی یافت میشوند و نقشی حیاتی در فرآیندهای زیستی ایفا میکنند؛ همچون یونهای آهن که در ساختار گلبولهای قرمز خونی وجود دارند یا یونهای پتاسیم که در عملکرد عضلات نقشی کلیدی ایفا میکنند.
ترکیبیات یونی کاربردهای فراوانی در صنایع دارند؛ همچون مواد رنگزا، مواد اولیه برای تولید محصولات دیگر، فرآوری بسیاری از فلزات، تولید باتری و پیلهای الکتروشیمیایی و …. در صنایع غذایی به عنوان نگهدارنده، طعمدهنده و عامل ورآورنده استفاده میشوند و در صنایع دارویی به عنوان تأمینکننده برخی ریزمغذیها کاربرد دارند. همچنین برخی داروها با روشهای ویژه به صورت ترکیبات یونی درآورده میشوند تا میزان فراهمی زیستی و اثرگذاری آنها افزایش یابد.
اکتشاف

ترکیبات یونی از دیرباز در زندگی بشر نقش داشته و برای انسان کاربردی بودهاند اما نخستین توضیحات علمی در مورد این ترکیبها به دانشمند انگلیسی مایکل فارادی برمیگردد. او متوجه شده بود که این ترکیبات در آب حل میشوند و بهوسیله جریان الکتریکی میتوان آنها را به اجزای سازنده آن تفکیک کرد. در سال ۱۸۳۴ وی این اجزا را «یون»[الف] نامید که در زبان یونانی به معنی «رونده» یا «متحرک» بود.[۲][۳] این موضوع موجب شد که وی نخستین قوانین الکترولیز در شیمی را تدوین کند. همچنین، سوانت آرنیوس دانشمند سوئدی در سال ۱۸۸۴ متوجه شد که نمک طعام یا همان سدیم کلرید در آب به اجزای سازنده آن یعنی یونهای مثبت و منفی تفکیک میشود.[۴]
نخستین شواهد از کشف ساختار بلوری ترکیبات یونی به سال ۱۹۱۳ بر میگردد؛ زمانی که ویلیام هنری و ویلیام لورنس براگ توانستند با اسپکتروسکوپ پرتوی ایکس خود، ساختار بلوری سدیم کلرید جامد را توصیف کنند.[۵][۶] این مطالعات نشان داد که ساختار این ترکیبات شکل مولکولی نداشته و در عوض، یک ساختار بلوری منظم در کل ماده تکرار شدهاست. همچنین مفهوم عدد همآرایی نیز در طی این تحقیقات مطرح شد که نشان میداد در بلور جامدِ سدیم کلرید، هر یون سدیم توسط ۶ یون کلرید احاطه شدهاست.[۷]
بعدها و در خلال دهه ۱۹۲۰ میلادی مطالعات بیشتر نشان داد که بسیاری از ترکیبهای معدنی دیگر نیز دارای چنین ساختارهای بلوری و منظمی هستند. همچنین، مشخص شد که ذراتی که کنار هم قرار گرفته و ساختار بلور را تشکیل میدهند، اتم خنثی نبوده و یونهای با بار ناهمنام هستند، به عبارتی یک نیروی الکترواستاتیکی قوی موجب کنار هم قرار گرفتن ذرات شدهاست. این فرضیه توسط بازتابندگی پرتو ایکس که چگالی الکترونها را اندازهگیری میکند، اثبات شد.[۸][۹]
مطالعه دیگری که به شناخت دقیقتر این ترکیبها انجامید، توسط دو دانشمند آلمانی به نامهای فریتس هابر و ماکس برن در سال ۱۹۱۹ انجام گرفت. نظریه آنها که به چرخه بورن–هابر مشهور بود، در واقع روشی بود که طی آن میتوان انرژی شبکه یک شبکه بلوری یونی را با استفاده از یک روش محاسباتی به دست آورد. این روش بر پایه قانون هس بنا شدهاست.[۱۰][۱۱]
منشأ طبیعی
ترکیبات یونی بخش مهمی از اجزای سازنده کره زمین هستند. سنگهای معدنی یکی از منابع غنی ترکیبات معدنی از جمله ترکیبات یونی هستند. تاکنون بیش از ۲۸۰۰ گونه سنگ معدنی شناسایی شدهاست که بخشی از آنها در تولید مواد شیمیایی و همچنین فلزات کاربرد دارند. بسیاری از ترکیبات یونی مانند سنگ آهک توسط جریانهای سطحی آب روی زمین شسته شده و به مناطق مختلف منتقل میشوند؛ در نتیجه، آب دریاها نیز یکی دیگر از منابع طبیعی حاوی ترکیبات یونی متنوع است.[۱۲][۱۳][۱۴] ترکیبات یونی به دلیل دمای ذوب و جوش بالا در طبیعت به صورت جامد بوده و به هیچ وجه به حالت گازی در هواکره وجود ندارند. اجزای عمده هواکره شامل گازهای ساده مانند گاز نیتروژن، اکسیژن و کربن دیاکسید هستند که همگی دارای ساختار مولکولی با پیوندهای کووالانسی هستند.[۱۵]
-
سنگ نمک یا هالیت حاوی سدیم کلرید
-
سنگ آهک حاوی کلسیم کربنات
-
هماتیت یکی از سنگهای طبیعی حاوی مقادیر قابل توجهی آهن(III) اکسید است.
-
شنگرف یا سینابر سنگ معدنی حاوی جیوه سولفید
-
مرمر سبز یا مالاکیت حاوی کربنات و هیدروکسید مس
-
کاسیتریت حاوی قلع(IV) اکسید
پیوند یونی

پیوند یونی یک پیوند شیمیایی است که به واسطه نیروی الکترواستاتیک بین یونهای مثبت (کاتیون) و یونهای منفی (آنیون) به وجود میآید. در طی تشکیل یک پیوند یونی، الکترونهای لایه ظرفیت از یک اتم خارج و به لایه ظرفیت اتم دیگر وارد میشوند. اتمی که الکترون از دست میدهد، دارای بار مثبت شده و کاتیون نام دارد و اتمی که الکترون دریافت میکند، دارای بار منفی شده و آنیون نام دارد. در یک جامد یونی، تعداد بسیار زیادی از این یونها در کنار هم با ساختاری منظم و بلورین در کنار هم قرار گرفته و تشکیل یک ترکیب یونی را میدهند.[۱۷] برای درک بهتر این فرایند به توصیف فرایند تشکیل سدیم کلرید از اتمهای سدیم و کلر میپردازیم:
سدیم کلرید جامدی سفید رنگ با دمای ذوب ۸۰۱ درجه سانتیگراد و دمای جوش ۱۴۳۹ درجه سانتیگراد است. این ماده علاوه بر مصارف صنعتی، به عنوان ماده خوراکی و طعمدهنده از گذشتههای دور کاربرد داشته و یکی از مثالهای ساده برای ترکیبات یونی است.[۱۸] ساختار الکترونی اتم سدیم و اتم کلر به صورت زیر است:
Na:[Ne]3s1
Cl:[Ne]3s23p5
همانگونه که مشخص است، در لایه ظرفیت اتم سدیم یک اوربیتال s با یک الکترون وجود دارد و با از دست دادن آن طبق قاعده هشتتایی به ساختار گاز نجیب پیش از خود یعنی نئون میرسد. اتم کلر نیز با گرفتن یک الکترون، اوربیتال p خود را کامل کرده و به ساختار پایدار گاز نجیب بعد خود یعنی آرگون میرسد:[۱۹]
Na+:[Ne]
Cl-:[Ne]3s23p6=[Ar]
حال دو اتم با تبادل الکترون به حال پایدار رسیدند و هر یک دارای بار مخالف شدهاند و به واسطه نیروی الکترواستاتیک به یکدیگر متصل و تشکیل پیوند یونی را میدهند.[۲۰]
از لحاظ ترمودینامیکی نیز دو اتم به تنهایی دارای انرژی بالایی میباشند و بسیار ناپایدار هستند. تشکیل پیوند یونی موجب آزاد شدن انرژی و پایداری اتمها میشود؛ در نتیجه، ترکیبهای یونی از اتمهای سازنده آنها پایدارتر هستند و عمدتاً در طبیعت به شکل ترکیب یافت میشوند.[۲۱][۲۲]
در واقعیت یک پیوند شیمیایی نه به صورت مطلق یونی و نه به صورت مطلق کووالانسی است. پیوندها درصدی از خصلت هر دو را با خود به همراه دارند اما برای پیوندهای یونی این خصلت بیشتر به سمت یونی متمایل است. تشخیص این موضوع با استفاده از قواعد فاجانس امکانپذیر است که نخستین بار در سال ۱۹۲۳ توسط شیمیدان لهستانی-آمریکایی کازیمیرز فاجانس مطرح شد.[۲۳] همچنین، به شکلی دقیقتر میتوان رفتار یونی یا کووالانسی پیوندها را با استفاده از نظریه اچاسایبی که نخستین بار در دهه ۱۹۶۰ توسط شیمیدان آمریکایی رالف پیرسون مطرح شد، توصیف کرد. این نظریه بیان میکند که از واکنش اسید و باز سخت،[ب] یک پیوند یونی و از واکنش اسید و باز نرم،[پ] یک پیوند کووالانسی تشکیل میشود.[۲۴]
ساختار

ترکیبات یونی در حالت جامد از یونهای مثبت و منفی تشکیل شدهاند که با ساختار هندسی منظم در کنار هم قرار گرفتهاند. مطالعه دقیق این ساختارها در حوضه مطالعات علم بلورشناسی قرار دارد. بسیاری از خواص ترکیبات یونی با این ساختار توجیهپذیرند. به عنوان مثال، سختی و براقیت این ترکیبات ناشی از چینش منظم یونها در یک شبکه سهبعدی است؛ در عین حال، عدم رسانایی الکتریکی این مواد در حالت جامد ناشی از محدود بودن یونها در ساختار بلوری و عدم توانایی آنها در حرکت است. همچنین، شکنندگی این مواد بر اساس این ساختار ناشی از کنار هم قرار گرفتن لحظهای یونهای همبار در یک لحظه و در اثر نیروی خارجی است.[۲۵]
چیدمان یونها در این ساختار همواره به گونهای است که کمترین انرژی شبکه (بیشترین جاذبه و کمترین دافعه) ممکن برای آن ساختار به وجود بیاید. انرژی شبکه یک ترکیب یونی عبارت است از انرژی آزادشده هنگام تشکیل یک مول جامد بلورین از یونهای گازی آن که میتواند معیار مناسبی برای اندازهگیری قدرت پیوند در ترکیبهای یونی باشد.[۲۶] انرژی شبکه در واقع جمع اثر متقابل نیروهای دافعه و جاذبه در یک ساختار بلوری است. برای یونهای کروی قطبشناپذیر، تنها بار و فواصل برای محاسبه انرژی جاذبه الکترواستاتیک کافی است. برای هر ساختار بلورین ایدهآل، تمام فاصلهها از نظر هندسی با کمترین فاصله بین هستهای مرتبطند؛ بنابراین، برای هر ساختار بلوری ممکن، انرژی الکترواستاتیک کل با انرژی الکترواستاتیک بارهای واحد در نزدیکترین فاصله همسایگی متناسب است. مقدار این انرژی همواره ضریبی از عددی ثابت به نام ثابت مادلونگ است.[۲۷] که به شکل مؤثری میتوان با جمع اوالد آن را محاسبه کرد.[۲۸] هنگامی که شکلی معقول برای انرژی دافعه اضافی مفروض باشد، انرژی شبکه کل را میتوان با استفاده از معادله برن–لانده،[۲۹] معادله برن–مایر و در صورت نبودن اطلاعاتی از ساختار شبکه، میتوان با استفاده از معادله کاپوستینسکی، مدلسازی کرد.[۳۰]
انرژی شبکه یک ترکیب یونی با تغییر میزان بار و شعاع یونها متغیر است؛ یونها هرقدر بار بیشتر و شعاع کمتری داشته باشند، انرژی شبکه بیشتر خواهد بود. به این ترتیب، میتوان با استفاده از این اصل، بدون اطلاع از مقدار دقیق انرژی شبکه دو ترکیب، مقدار انرژی شبکه و به تبع آن، دمای ذوب دو ترکیب را با هم مقایسه کرد.[۳۱]
ساختارهای یونی بلورین مولکول مشخص ندارند و از یک شبکه بزرگِ به هم پیوسته از یونها تشکیل شدهاند؛ در نتیجه، فرمول شیمیایی آنها را با استفاده از سادهترین نسبت کاتیونها به آنیونها که در کل ساختار بلوری تکرار میشود، نشان میدهند. این نسبت ساده را سلول واحد مینامند.[۳۲] بر این اساس، ۷ دستگاه بلوری اصلی و ۱۴ شبکه براوه وجود دارد.
| سهشیب (تریکلینیک) | تکشیب (مونوکلینیک) | راستلوزی (اورتورومبیک) | چهارگوشه (تتراگونال) | ششگوشه (هگزاگونال) | سه گوشه (تریگونال) | مکعبی (کوبیک) |
|---|---|---|---|---|---|---|
 |
 |
 |
 |
 |
 |

|
عیوب ساختاری

ساختارهای ذکر شده شکل ایدهآلی از قرارگیری هندسی یونها در شبکه بلوری است. در واقعیت ممکن است انحرافهایی نسبت به این ساختارها در ترکیب به وجود بیاید که به ناکاملی یا عیوب بلور معروف است. عیوب بلوری بر اساس شکل قرارگیری عیوب (روی نقطه، خط، صفحه یا حجم) به چهار دسته تقسیم میشوند:[۳۴]
- عیوب نقطهای یا بدون بعد: تنها باعث اخلال در نظم بلوری در یک یا دو موقعیت اتمی میشوند.
- عیوب خطی یا تک بعدی: باعث اخلال در نظم بلوری در یک مسیر خطی(یک ضلع شبکه) میشوند.
- عیوب سطحی یا دو بعدی: باعث اخلال در نظم بلوری در یک رویه یا صفحه میشوند.
- عیوب حجمی یا سه بعدی: باعث اخلال در نظم بلوری در یک حجم میشوند.
نامگذاری
روش سنتی
در گذشته روش نظاممندی در نامگذاری این ترکیبات وجود نداشت و صرفاً بر اساس رنگ، ظاهر، محل کشف یا استخراج، کاربردها و دیگر باورهای سنتی نامگذاری میشدند.
- نمکها
نمکها به دستهای از ترکیبات یونی اطلاق میشود که از واکنش خنثی سازی یک باز و یک اسید به وجود میآیند. نمک خوراکی یا نمک طعام که همان سدیم کلرید است، نمونهای از دسته نمکها است که از واکنش هیدروکلریک اسید و سدیم هیدروکسید به وجود میآید. همچنین، در این دستهبندی زیرمجموعه دیگری نیز وجود دارد؛ بر این اساس، ممکن است نمک بازی، اسیدی یا خنثی باشد. نمکهایی مانند Na۳HPO۴ و NaHCO۳ که با انحلال در آب خاصیت اسیدی ایجاد میکنند، نمک اسیدی، نمکهایی مانند Pb(OH)Cl و Sn(OH)Cl که با حل شدن در آب یون هیدروکسید (−OH) ایجاد میکنند، نمک بازی و نمکهایی مانند Na۲SO۴ و Na۳PO۴ که در آب خنثی هستند، نمک خنثی نامیده میشوند.[۳۵][۳۶]
- آب + نمک → باز + اسید
- HCl + NaOH → NaCl +H۲O
- زاجها

زاجها[ت] دستهای از ترکیبات یونی با فرمول کلی XAl(SO
۴)
۲·۱۲H
۲O هستند که در واقع نمک آبپوشیده و مضاعفی از آلومینیم سولفات و سولفات یک کاتیون تک ظرفیتی مانند پتاسیم است. در این فرمول کلی X میتواند یک کاتیون تک ظرفیتی مانند پتاسیم یا سدیم باشد. در نامگذاری این ترکیبات به شیوه قدیمی از ترکیب نام کاتیون تک ظرفیتی و عبارت «زاج» استفاده میشود. برخی از زاجهای مهم عبارتند از زاج سدیم (NaAl(SO۴)۲·۱۲H۲O)، زاج پتاسیم (KAl(SO۴)۲·۱۲H۲O) و زاج آمونیوم (NH
۴Al(SO
۴)
۲·۱۲H
۲O).[۳۷][۳۸]
زاجها در صنایع دباغی، نساجی و کاغذسازی و همچنین برای تهیه بیکینگ پودر کاربرد دارند. این ترکیبات به عنوان عامل لختهساز در صنایع تصفیه آب نیز کاربرد دارند.[۳۹]
- دیگر نامها
از آنجا که در گذشته روش نظاممندی برای شناخت و نامگذاری ترکیبات شیمیایی وجود نداشته، برخی از آنها اسمهای مختلفی داشتهاند. گاه از روی رنگ و ظاهر ماده نامی انتخاب میشد؛ مانند «کات کبود» که همان مس(II) سولفات آبپوشیده است و به خاطر ظاهر کبودرنگ آن به این نام شناخته میشد.[۴۰]
برخی ترکیبات به نام مکان خاصی نامگذاری شدهاند؛ مانند «آبی پروسی» [ث] که در فارسی به «نیل فرنگی» هم شناخته میشود. این ترکیب که امروزه با نام فریک فروسیانید و برخی دیگر از اسامی شناخته میشود، یک رنگدانه آبی پررنگ است. تاریخچه نامگذاری آن به قرن ۱۸ میلادی بر میگردد؛ زمانی که ارتش پادشاهی پروس از این رنگدانه در البسه سربازان استفاده میکرد. این ترکیب همچنین با نامهای «آبی برلین» [ج] و «آبی پاریسی» [چ] نیز شناخته میشود.[۴۱][۴۲]
روش مدرن
در روش امروزی که توسط آیوپاک تصویب شدهاست، بهطور کلی نام ترکیب یونی از ترکیب نام کاتیون و آنیون تشکیل دهنده ترکیب، ساخته میشود. برای ترکیبات ساده دوتایی[ح] (ترکیباتی که در آن کاتیون و آنیون تنها از یک نوع اتم ساخته شدهاند، مانند NaCl، CaBr۲ ،LiI ،AlN و …) ابتدا نام کاتیون که یک فلز است، بدون تغییر میآید؛ سپس نام آنیون با افزودن -ید یا -اید (در انگلیسی به صورت ide-) به انتهای نام نافلز تشکیلدهنده آنیون میآید.[۴۳][۴۴][۴۵]
- کلسیم برمید → برم + کلسیم
- Ca + Br۲ → CaBr۲
برای درک روش اندیسگذاری در این ترکیبات باید به این قاعده توجه داشت که باید قدر مطلق بار کاتیون به عنوان اندیس آنیون و قدر مطلق بار آنیون به عنوان اندیس کاتیون در نظر گرفته شود.[۴۶] برای نمونه در مثال قبل:
- Ca۲+ + Br۱- → Ca۱ + Br۲ → CaBr۲
در برخی فلزات واسطه ممکن است اتم قادر به تولید بیش از یک کاتیون با بارهای متفاوت باشد؛ مثلاً اتم آهن توانایی تولید یونهای Fe2+
و Fe3+
را دارد. در این حالت در نامگذاری نام کاتیون برای جلوگیری از اشتباه شدن بین دو کاتیون، تعداد بار را باید با اعداد رومی در داخل پرانتز ذکر کرد. در مثال بالا نام کاتیونها به این صورت خواهد بود: آهن(II) و آهن(III).[۴۷] علاوه بر این روش که روش امروزی نامگذاری کاتیونهای چند ظرفیتی است، روش نامگذاری سنتیای نیز برای آن وجود دارد؛ به این ترتیب که کاتیون با بار کمتر با پسوند -وس (در انگلیسی به صورت ous-) و کاتیون با بار بیشتر با پسوند -یک (در انگلیسی به صورت ic-) نامگذاری میشوند.[خ] به عنوان مثال، ترکیبهای FeCl۲ و FeCl۳ در روش جدید با نامهای آهن(II) کلرید و آهن(III) کلرید و در روش قدیمی با نامهای فروس کلرید و فریک کلرید نامگذاری میشوند.[۴۸]
برخی از کاتیونها و آنیونهای تکاتمی پرکاربرد به همراه بار و نام آنها در جدول زیر آمدهاند:[۴۹]
| کاتیون | بار | نام | آنیون | بار | نام | کاتیون چند ظرفیتی | بار | نام | نام قدیمی | معادل فارسی |
| H+ | ۱+ | هیدروژن | H- | ۱- | هیدرید | Fe۲+ | ۲+ | (II)آهن | ferrous | فروس |
| Li+ | ۱+ | لیتیم | F- | ۱- | فلورید | Fe۳+ | ۳+ | (III)آهن | ferric | فریک |
| Na+ | ۱+ | سدیم | Cl- | ۱- | کلرید | Cr۲+ | ۲+ | (II)کروم | chromous | کروموس |
| K+ | ۱+ | پتاسیم | Br- | ۱- | برمید | Cr۳+ | ۳+ | (III)کروم | chromic | کرومیک |
| Cs+ | ۱+ | سزیم | I- | ۱- | یدید | Cu+ | ۱+ | (I)مس | cuprous | کوپروس |
| Ag+ | ۱+ | نقره | O۲- | ۲- | اکسید | Cu۲+ | ۲+ | (II)مس | cupric | کوپریک |
| Mg۲+ | ۲+ | منیزیم | S۲- | ۲- | سولفید | Sn۲+ | ۲+ | (II)قلع | stannous | استانوس |
| Ca۲+ | ۲+ | کلسیم | Se۲- | ۲- | سلنید | Sn۴+ | ۴+ | (IV)قلع | stannic | استانیک |
| Sr۲+ | ۲+ | استرانسیم | N۳- | ۳- | نیترید | Co۲+ | ۲+ | (II)کبالت | - | - |
| Ba۲+ | ۲+ | باریم | P۳- | ۳- | فسفید | Co۳+ | ۳+ | (III)کبالت | - | - |
| Zn۲+ | ۲+ | روی | - | - | - | Pb۲+ | ۲+ | (II)سرب | - | - |
| Al۳+ | ۳+ | آلومینیوم | - | - | - | Pb۴+ | ۴+ | (IV)سرب | - | - |

گونه دیگری از کاتیونها و آنیونها وجود دارند که خود از چند اتم تشکیل شدهاند و به آنها به اصطلاح یون چنداتمی[د] گفته میشود. به عنوان مثال، یون سولفات یک آنیون چند اتمی است که در آن یک اتم گوگرد با ۴ اتم اکسیژن بهوسیله پیوند کووالانسی و به شکل هرم چهاروجهی با یکدیگر پیوند دارند. کل این ساختار دارای بار -۲ است. به شکل مشابه کاتیونهای چند اتمی با بار مثبت نیز وجود دارند. مثلاً آمونیوم یک کاتیون است که در آن یک اتم نیتروژن با چهار اتم هیدروژن بهوسیله پیوند کووالانسی و به شکل هرم چهاروجهی در کنار هم قرار گرفتهاند.[۵۱] علاوه بر کاتیون یا آنیونهایی که در آنها اتمها با پیوند کووالانسی به هم متصل هستند، ممکن است یون چند اتمی از یک کمپلکس شیمیایی ساخته شده باشد. به عنوان مثال، تتراکلروپلاتینات یک آنیون با بار کلی -۲ است که در آن یک اتم پلاتین با چهار اتم کلر تشکیل یک کمپلکس را دادهاند که دارای بار خالص -۲ است.[۵۲]
اکسیآنیونها دسته مهمی از آنیونهای چند اتمی هستند که شامل اتم اکسیژن و یک اتم دیگر است.[۵۳] این آنیونها در اصل از جداشدن اتم هیدروژن از یک اسید به وجود میآیند. به عنوان مثال، −ClO آنیون حاصل از جدا شدن هیدروژن از HClO است. برای نامگذاری این آنیونها به روش زیر عمل میشود:[۵۴]
اسیدهایی مانند کلرو اسید (HClO۲) که به «و» ختم میشوند، به کلریت (−ClO۲) و اسیدهایی مانند کلریک اسید (HClO۳) که به «یک» ختم میشوند، به کلرات (−ClO۳) تبدیل میشوند.[ذ][۵۵]
در جدول زیر فهرستی از آنیونها و کاتیونهای چند اتمی پرکاربرد و ریز مشخصات آنها ذکر شدهاست:[۵۶][۵۷][۵۸][۵۹][۶۰][۶۱]
| کاتیونها | آنیونها | |||||||
|---|---|---|---|---|---|---|---|---|
| نام | فرمول شیمیایی | ساختار | نام | فرمول شیمیایی | ساختار | نام | فرمول شیمیایی | ساختار |
| گوانیدین | C(NH 2)+ 3 |

|
هیپوکلریت[ر] | ClO– |

|
فسفات | PO3− 4 |
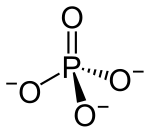
|
| آمونیوم | NH+ 4 |

|
کلریت[ز] | ClO– 2 |

|
منگنات | MnO2− 4 |

|
| هیدرونیوم | H 3O+ |
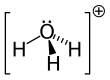
|
کلرات[ژ] | ClO– 3 |

|
پرمنگنات | MnO− 4 |

|
| فلورونیوم | H 2F+ |

|
پرکلرات[س] | ClO– 4 |

|
نیتریت | NO− 2 |
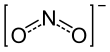
|
| پیریلیوم | C 5H 5O+ |

|
سولفیت | SO2− 3 |

|
نیترات | NO− 3 |

|
| - | - | - | سولفات | SO2− 4 |

|
کرومات | CrO2– 4 |

|
| - | - | - | کربنات | CO2− 3 |

|
دیکرومات | Cr 2O2– 7 |

|
| - | - | - | هیدروکسید | OH− |

|
سیانید | CN− |
|
واکنشها
واکنشهای جابجایی

واکنشهای جابجایی دستهای واکنشها هستند که در آنها یک اتم یا یک یون از یک ترکیب با یک اتم یا یک یون از ترکیبی دیگر جابجا میشود.[۶۲] این واکنش به دو صورت امکانپذیر است:
- در حالت اول یک اتم یا یون جابجا میشود؛ مانند فرمول کلی زیر:
- A + B-C → A-C + B
به این واکنشها واکنش جابجایی یگانه[ش] گفته میشود؛ مانند واکنش نقره نیترات محلول با فلز روی که منجر به آزاد شدن فلز نقره و تولید روی نیترات میشود. اهمیت این واکنش از آن جهت است که میتوان بهوسیله آن یک عنصر را بهوسیله عنصری دیگر از یک ترکیب خارج و تخلیص کرد.[۶۳]
- در حالت دوم دو عمل جابجایی اتم یا یون صورت میگیرد؛ مانند فرمول کلی زیر:
- A-B + C-D → A-D + C-B
به این واکنشها، واکنش جابجایی دوگانه یا مضاعف[ص] گفته میشود؛ مانند واکنش نقره نیترات و ترکیبات یونی هالیددار مانند سدیم کلرید. این واکنشها منجر به تشکیل رسوبی قابل جداسازی میشوند؛ به همین دلیل، به آنها واکنشهای رسوبی[ض] نیز گفته میشود. اهمیت این واکنشها در شیمی تجزیه از آن جهت است که میتوان از طریق تشکیل انواع مختلفی از رسوبات، به نوع عناصر موجود در ترکیب پی برد. در مثال گفتهشده وجود یون کلرید در ترکیب یونی بهوسیله نقره نیترات و با تشکیل رسوب نقره کلرید ردیابی میشود.[۶۴]
- AgNO۳(aq) + NaCl(aq) → AgCl(s) + NaNO۳(aq)
واکنشهای الکتروشیمیایی
همانطور که از نام ترکیبات یونی پیداست، این مواد از یونهای با بار مثبت و منفی تشکیل شدهاند. در حالت جامد یونها در یک ساختار بلورین قرار داشته و توانایی حرکت ندارند اما در صورتی که این ترکیبات به شکل مذاب درآمده یا در آب به صورت محلول در بیایند، امکان تحرک و جابجایی یونها فراهم میشود و در نتیجه انجام واکنشهای الکتروشیمیایی با اعمال جریان الکتریکی امکانپذیر میشود. جابجایی یون بین الکترودهای آند و کاتد در پیلهای الکتروشیمیایی اساس عملکرد باطریهای شیمیایی متداول است. همچنین، با اعمال جریان خارجی بر یک محلول یا مذاب حاوی ترکیب یونی امکان تولید مواد شیمیایی جدید فراهم میشود که این موضوع در صنایع شیمیایی از اهمیت بالایی برخوردار است. این عمل اصطلاحاً برقکافت نامیده میشود.[۶۵]
-
آبکاری الکترولیتی روشیست که در آن با کاهش کاتیونهای فلزی موجود در محلول، لایهای از آن به عنوان پوشش بر روی سطح فلز دیگر (Me) نشانده میشود
-
طرحی ساده از یک پیل الکتروشیمیایی حاوی محلول مس(II) سولفات و روی سولفات که جهت تولید جریان الکتریکی استفاده میشود
-
فرایند هال–هرولت فرایندی صنعتی جهت تولید انبوه فلز آلومینیم به روش برقکافت است. این روش نخستین بار توسط دو دانشمند به نامهای چارلز مارتین هال و پائول هرولت در سال ۱۸۸۶ میلادی ابداع گردید.[۶۷]
تجزیه
ترکیبات یونی به دلیل داشتن پیوند قوی در دماهای بالا و در شرایط سختی تجزیه میشوند. تجزیه حرارتی این ترکیبات از مهمترین واکنشهای این دسته ترکیبات هستند. در طی این فرایند ترکیب یونی به دو یا چند جز سادهتر تجزیه میشود. مثلاً جیوه (II) اکسید که رنگی نارنجی دارد در اثر حرارت به اجزای سازنده آن یعنی فلز جیوه و گاز اکسیژن تجزیه میشود.[۶۹] برخی از واکنشهای تجزیه از الگوهای خاصی پیروی میکنند؛ مثلاً کربناتهایی مانند کلسیم کربنات، منیزیم کربنات و باریم کربنات در اثر حرارت بالا به کلسیم اکسید، منیزیم اکسید و باریم اکسید تجزیه میشوند و گاز کربن دیاکسید آزاد میکنند.[۷۰]
آزیدها در اثر تجزیه حرارتی از خود گاز نیتروژن آزاد میکنند که همین ویژگی در ساخت کیسههای هوای خودرو کاربرد دارد. به عنوان مثال، سدیم آزید یا باریم آزید در اثر تجزیه حرارتی به ترتیب فلز سدیم و باریم تولید و گاز نیتروژن آزاد میکنند.[۷۱]
کلراتها میتوانند با تجزیه شدن، گاز اکسیژن آزاد کنند. اهمیت این واکنش از آن جهت است که میتواند منبع مناسب و در دسترسی برای تأمین گاز اکسیژن خالص از یک ماده جامد در محیط آزمایشگاهی باشد. به عنوان مثال، پتاسیم کلرات در اثر حرارت و در حضور کاتالیزور منگنز دیاکسید، به پتاسیم کلرید تبدیل شده و گاز اکسیژن آزاد میسازد.[۷۲]
عمده واکنشهای تجزیه از نظر ترمودینامیکی گرماگیرند اما معدود واکنشهایی مانند تجزیه آمونیوم دیکرومات در ابتدا برای شروع واکنش نیاز به انرژی فعالسازی اولیه دارند، اما در ادامه واکنش خودبهخود انجام میشود که با آزادسازی گرما نیز همراه است.[۷۳]
- (g)NH۴)۲Cr۲O۷(s) → Cr۲O۳(s) + N۲(g) + 4H۲O)
ترکیبهای یونی آبپوشیده
برخی ترکیبات یونی در هنگام رسوب دادن در محلولهای آبی، تعدادی مولکول آب در داخل ساختار بلوری خود نگه میدارند. به این دسته ترکیبات یونی، «آبپوشیده» گفته میشود. در این حالت، اتمهای اکسیژن آب با کاتیونهای بلور و اتمهای هیدروژن آب با آنیونهای بلور برهمکنش کوئوردیناسیونی برقرار میکنند. معمولاً تعداد مولکولهای آب به ازای هر واحد بلور نمایش داده میشود؛ به عنوان نمونه، در هر واحد بلوری مس(II) سولفات آبپوشیده بهطور معمول ۵ مولکلول آب وجود دارد؛ در نتیجه به شکل (CuSO۴·۵H۲O) نمایش داده میشود. مولکولهای آب موجود در نمکهای آبپوشیده با حرارت دیدن در بازه دمایی ۱۰۰ تا ۲۰۰ درجه سانتی گراد از ساختار بلور خارج میشوند. این فرایند در برخی ترکیبات با تغییر رنگ و ظاهر بلور نیز همراه است؛ به عنوان مثال، ترکیب مس(II) سولفات در حالت آبپوشیده کبودرنگ است ولی با خروج آب از آن سفیدرنگ میشود. ترکیب کبالت(II) کلرید در حالت آبپوشیده به رنگ زرشکی و در حالت بیآب به رنگ فیروزهای است. این ویژگی در ترکیبات آببپوشیده میتواند روش مناسبی برای نمبینی و تشخیص وجود آب و رطوبت باشد.[۷۴][۷۵]
-
بلور کبالت(II) کلرید آب پوشیده (CoCl۲·۶H۲O)
-
کبالت(II) کلرید بی آب (CoCl۲)
خواص و ویژگیها


خواص فیزیکی و ظاهری
ترکیبات یونی، پیوند قوی یونی دارند. پس در دمای اتاق به صورت جامد و بلورینند و دمای ذوب بالایی دارند. برای مثال، دمای ذوب سدیم کلرید ۸۰۱ درجه سانتی گراد و منیزیم اکسید ۲۸۰۰ درجه سانتی گراد است. این اختلاف فاحش ناشی از تفاوت انرژی شبکه ترکیبات یونی مختلف است؛ به گونهای که هر قدر انرژی شبکه بیشتر باشد، گرمای بالاتری برای سست کردن پیوندها و تبدیل آن به فاز مایع نیاز است.[۷۶]
این ترکیبات بر خلاف فلزات، شکننده و فاقد چکش خواریاند. با توجه به ساختار بلورین این ترکیبات، این پدیده به این صورت قابل توجیه است که در اثر وارد شدن نیروی خارجی به یک ساختار یونی، یونهای با بار موافق به صورت لحظهای در مجاورت هم قرار میگیرند و با توجه به نیروی دافعه الکترواستاتیکی بین دو ذره همنام، ساختار بلور از ناحیه وارد شدن نیرو دچار شکستگی میشود. طبیعتاً با توجه به انرژی شبکه بلور و میزان استحکام پیوند بین یونها، نیروی مورد نیاز برای شکستن ترکیبات یونی مختلف متفاوت است.[۷۷][۷۸]
رنگ و شکل ظاهری ترکیبات یونی بسیار متنوع است و به عواملی چون نوع کاتیونها و آنیونها، ساختار بلوری، آبپوشیده بودن یا نبودن و همچنین نقص در ساختار بلوری آنها بستگی دارد. بیشتر ترکیبات یونی شامل عناصر گروه اصلی جدول تناوبی بیرنگ و پارامغناطیساند؛ در حالی که ترکیبات یونی شامل عناصر واسطه عمدتاً رنگی و دیامغناطیساند و برخی از آنها به عنوان رنگدانه نیز کاربرد دارند.[۷۹][۸۰]
نمکهای اسیدی و بازی
ترکیبات یونیای که در آب حل میشوند، میتوانند تغییراتی در pH محلول ایجاد کنند که بر این اساس به سه دسته نمکهای اسیدی، بازی و خنثی طبقهبندی میشوند.[۸۱]
به عنوان مثال، میتوان به ترکیب سدیم سیانید اشاره کرد. این ترکیب به صورت زیر در آب تفکیک میشود:
- NaCN(s) → Na+(aq) + CN–(aq)
یون +Na با آب واکنشی ندارد اما یون −CN به شکل زیر با آب واکنش نشان میدهد:
- CN–(aq) + H
2O(l) ⇌ HCN(aq) + OH–(aq)
با توجه به نظریه اسید–باز برونستد–لوری یون −CN یک گیرنده پروتون(+H) است؛ در نتیجه، محلول NaCN خاصیت بازی پیدا میکند. از دیدگاهی دیگر نیز با توجه به نظریه آرنیوس، تولید (−OH) در این فرایند گواه دیگری بر بازی بودن محلول حاصل است.[۸۲]
به همین ترتیب، ترکیبی مانند NH۴Cl با انحلال در آب، تولید یون −Cl و NH+
۴ میکند. یون −Cl با آب واکنش نمیدهد ولی یون NH+
۴ نقش دهنده پروتون(+H) را ایفا میکند؛ در نتیجه، یک اسید است و به محلول خاصیت اسیدی میدهد.[۸۳] ترکیبی چون NaCl نیز پس از انحلال در آب تولید یونهای +Na و −Cl میکنند که هیچیک نه گیرنده و نه دهنده پروتون(+H) هستند؛ درنتیجه، نمک خنثی محسوب میشود.[۸۴]
رسانایی الکتریکی
ترکیبات یونی در حالت جامد از یونهای بههمفشرده تشکیل شدهاند که امکان هیچگونه تحرکی ندارند؛ در نتیجه، این ترکیبات در حالت جامد رسانایی الکتریکی ندارند اما در صورتی که این یونها امکان تحرک پیدا کنند، توانایی ایجاد جریان الکتریکی را دارند. این امر در ترکیبات یونی مذاب و همچنین محلولهای حاوی کاتیونها و آنیونها امکانپذیر است. در این حالت، یونها به طرف الکترود با بار مخالف حرکت میکنند و با از دست دادن یا گرفتن الکترون، خنثی میشوند. این پدیده موجب به وجود آمدن جریانی از یونها در داخل محلول میشود که در نتیجه ایجاد رسانایی الکتریکی مینماید.[۸۵]
موادی که با تفکیک شدن به یونهای مثبت و منفی میتوانند ایجاد رسانایی الکتریکی نمایند، اصطلاحاً الکترولیت نام دارند. هر قدر الکترولیت توانایی تفکیک بالاتری داشته باشد و بتواند تعداد بیشتری یون ایجاد نماید، الکترولیت قویتری است.[۸۶]
انحلالپذیری
همانطور که از نام ترکیبات یونی پیداست، این ترکیبات از یونهای مثبت و منفی تشکیل شدهاند. در حالت جامد این یونها در یک شبکه منظم در کنار هم قرار گرفته و یک شبکه منسجم تشکیل میدهند اما در صورت قرار گرفتن در یک حلال قطبی همانند آب، این یونها تفکیک شده و در حلال حل میشوند. فرایند حل شدن شامل جدا شدن یونها از یکدیگر و تشکیل پیوند بین مولکولهای آب و یونها است. آنیونها که دارای بار منفی هستند، به قطب مثبت مولکول حلال (در مولکول آب اتم هیدروژن) و کاتیونها که بار منفی دارند، به طرف قطب منفی مولکول حلال (در مولکول آب اتم اکسیژن) جذب میشوند. فرایند جدا شدن یونها گرماگیر و فرایند تشکیل پیوند بین یونها و مولکولها فرآیندی گرماده است.[۸۷]
با توجه به این اصل، محلول، نامحلول یا کممحلول بودن ترکیبات یونی در حلال را میتوان توجیه کرد. به این ترکیب که در صورت محلول بودن ترکیب یونی، انرژی تشکیل پیوند بین حلال و یون بیشتر است و امکان تأمین انرژی کافی برای تفکیک یونها را فراهم میآورد و هر قدر این اختلاف انرژی بیشتر باشد، این انحلالپذیری بیشتر است. در نقطه مقابل ترکیبی نامحلول یا کممحلول است که انرژی مورد نیاز برای تفکیک یونهای آن بالا بوده و امکان تأمین آن از طریق تشکیل پیوند بین یون و مولکول حلال فراهم نمیباشد. به عنوان نمونه، ترکیب AgCl تنها ۰٫۰۰۹ گرم در لیتر آب حل میشود که نشان دهنده بالا بودن انرژی مورد نیاز برای تفکیک یونها است؛ در حالی که NaCl به میزان ۳۶۵ گرم در لیتر آب قابل حل است.[۸۸]
انحلالپذیری ترکیبات یونی به دما وابستگی دارد. برخی ترکیبات مانند KNO۳ با افزایش دما به مقدار بیشتری در آب حل میشوند؛ در نقطه مقابل، ترکیبی مانند Ce۲(SO۴)۳ با افزایش دما به مقدار کمتری در آب حل میشود.[۸۹]
نقش حیاتی

۱ - دومِـینهای پروتئینی کانال (بهطور معمول ۴ عدد برای هر کانال)
۲ - دهلیز بیرونی
۳ - پالایهٔ انتخابکننده
۴ - قطر پالایهٔ انتخابکننده
۵ - جایگاه فسفریلاسیون
۶ - غشای سلولی.

یونها نقشی حیاتی در عملکرد سلولی و اندامهای بدن دارند. به عنوان مثال، پتانسیل عمل در سیستم عصبی بدن توسط تعامل سه یون سدیم، پتاسیم و کلسیم ایجاد میشود. بسیاری از یونها چون سدیم، پتاسیم، کلسیم، منیزیم، آهن، مس، منگنز، روی، کبالت، سلنیوم، منگنز، مولیبدن، کلرید، نیترات، فسفات و بیکربنات در بدن انسان به مقادیر مشخصی وجود دارند و کاهش یا تغییر در نسبت این یونها میتواند موجب بروز بیماری یا نارساییهایی در بدن شود. برخی از اعمال حیاتی و مهم یونها در بدن انسان یا گیاهان به شرح زیر است:
- Ca۲+: جزئی از استخوان و دندان است و در ترارسانی پیام (در نقش پیغامبر ثانویه)، پیامرسانی عصبی در یاختههای عصبی، انقباض ماهیچهای، انعقاد خون و لقاح نقش داشته و کوفاکتور بسیاری از آنزیمهاست.[۹۰] برای کمبود آن هیپوکلسمی را ببینید.
- Zn۲+: بیشتر در نقش آنتیاکسیدان (بهویژه در کبد)[۹۱] ظاهر میشود. این یون نقش تثبیتکننده برای مولکولهای بزرگی دارد که میل ترکیبی زیادی با روی دارند؛ بهویژه در جایگاههای غنی از سیستئین در چینها پروتئینی.[۹۲] روی یکی از اجزاء مهم انگشت روی در برخی پروتئینهاست.[۹۳]
- K+: نقش اصلیاش تنظیم فشار اسمزی بهویژه در کلیههاست. این یون نقش مهمی در حفظ پتانسیل غشا دارد. از وظایف دیگر آن، شلشدگی ماهیچهها، کاهش فشار خون، ترشح انسولین و غیره است.[۹۴] برای کمبود آن هیپوکالمی و برای افزایش آن هایپرکالمی را ببینید.
- Na+: نقش مشابهی با پتاسیم دارد. ایجادکنندهٔ اصلی دیپولاریزاسیون سلولی است و نقش مهمی در حرکت بدن و شناخت دارد.[۹۵] برای کمبود آن هیپوناترمی و برای افزایش آن هایپرناترمی را ببینید.
- Mg۲+: کوفاکتور بیش از ۳۰۰ واکنش شیمیایی مهم بدن است و برخی واکنشهای زیستپزشکی را تنظیم میکند.[۹۶] در ساخت پروتئین، رشد استخوان، تولید انرژی، ضربان طبیعی قلب، تنظیم فشار و قند خون، عملکرد اعصاب و ماهیچهها و برخی اعمال حیاتی دیگر نقش مهمی دارد.[۹۷] این یون همچنین جزئی از ساختار کلروفیل در گیاهان است.
- Mn۲+: تثبیتکننده ساختار پروتئین است و بخش مهمی از ساختمان آنزیمها و پروتئینها محسوب میشود.[۹۸] یک نمونهٔ مهم این آنزیمها، سوپراکسید دیسموتاز است.[۹۹] در مغز انسان، منگنز بهصورت یک پروتئین فلزی، بهخصوص در ساختار گلوتامین سنتتاز در آستروسیتها مشاهده میشود.[۱۰۰] افزایش بیش از حد آن ممکن است با بروز بیماریهای تخریبی عصبی چون پارکینسون مرتبط باشد.[۱۰۱][۱۰۲]
- Cl−: در تنظیم فشار اسمزی، تعادل یونی بدن و همایستایی اسید-باز نقش دارد. کلر فراوانترین آنیون بدن است و مسئول بیش از یکسوم تونیسیته مایع خارج سلولی است.[۱۰۳][۱۰۴] یون کلر در ساختار کانال یونی دریچه لیگاندی و مجرای یونی وابسته به ولتاژ حاضر است و در انتقال سایر یونها از خلال غشای سلولی نقش دارد.[۱۰۵] اختلال در کانالهای یونی کلریدی در بروز فیبروز سیستیک، پوکی استخوان و صرع دخالت دارد. افزایش فعالیت این کانالهای کلریدی در پیشرفت گلیوما و رشد مالاریا در گلبولهای قرمز خون حائز اهمیت است.[۱۰۶]
- CO۲−
۳: نقش مهمی در بافرینگ و حفظ پیاچ بدن دارد.[۱۰۷] در خون، حدود ۸۵٪ دیاکسید کربن به کربنات آبی مبدل شده که حمل و نقل آنرا آسان میسازد. - Co۲+: میزان آن در بدن ۱ تا ۲ میلیگرم است[۱۰۸] و بیشتر در قلب، کبد، کلیهها و طحال (و با مقادیر کمتری در لوزالمعده، مغز و خون) یافت میشود.[۱۰۹][۱۱۰] کبالت بخش مهمی از ساختار ویتامین ب۱۲ و یک کوآنزیم حیاتی در جریان میتوز است.[۱۱۱] کبالت برای ساخته شدن اسیدهای آمینه و برخی پروتئینها و غلاف میلین در رشتههای عصبی ضروری است[۱۱۲][۱۱۳] و در پیامرسانی عصبی هم نقش مهمی دارد.[۱۱۴]
- PO۳−
۴ جزئی از ساختمان آدنوزین تریفسفات است که تأمینکننده و ذخیرهکننده انرژی در بدن است. بهصورت کلسیم فسفات در ساختمان استخوانها حضور دارد. - Fe۲+/Fe۳+: هستهٔ مرکزی هموگلوبین است که حملکننده اکسیژن در بدن است و در ساختار میوگلوبین هم وجود دارد. آهن یکی از اجزای مهم آنزیمهای تنفس یاختهای و فرایند اکسایش-کاهش در جانواران و گیاهان است.[۱۱۵] کمبود آهن، شایعترین نوع سوءتغذیه در انسان است[۱۱۶][۱۱۷][۱۱۸][۱۱۹] و سبب کمخونی میشود. از طرف دیگر، آهن زیاد سبب بروز هموکروماتوز در انسان میشود.[۱۲۰] افزایش آهن که گاهی ناشی از مصرف بیش از حد گوشت است، سرعت رشد تومور را افزایش داده و میتواند در بروز برخی سرطانها[۱۲۱] نقش داشته باشد.
- NO−
۳: منبع اصلی نیتروژن در گیاهان برای ساخت پروتئین است. در انسان این یون در بروز مِتهِموگلوبینِـمی نقش دارد.[۱۲۲][۱۲۳]
کاربردها
بهعنوان ماده اولیه
ترکیبات یونی طیف گستردهای از مواد با خواص متنوع و پیچیده را شامل میشوند؛ در نتیجه، کاربردهای گستردهای در تولید دیگر مواد تجاری دارد. به عنوان مثال، ترکیبات حاوی یون لیتیوم در تولید باتریهای یونلیتیم کاربرد دارند.[۱۲۴] ترکیبات حاوی یون فلورید مانند سدیم مونوفلوروفسفات برای جلوگیری از پوسیدگی دندان در خمیر دندانها استفاده میشود.[۱۲۵] برخی از ترکیبات یونی مانند کلسیم اکسید خود به عنوان ماده اولیه در تولید دیگر ترکیبات یونی مانند سدیم هیدروکسید، سدیم کربنات و کلسیم کاربید کاربرد دارند.[۱۲۶] انواع سیمانها محصولات شیمیایی تجاری هستند که در تولید آنها از مواد اولیهای مانند کلسیم سیلیکاتها، آلومیناتها و سولفاتها استفاده میشود.[۱۲۷]
ترکیبات یونی حاوی طیف گستردهای از عناصر هستند و اکثر عناصر به نوعی در ترکیبات یونی حضور دارند؛ در نتیجه، از این ترکیبات میتوان به عنوان ماده اولیه در فرآوری دیگر عناصر بهره برد. مثلاً میتوان فلز جیوه را با حرارت دادن جیوه سولفید که بخش عمده کانسنگ شنگرف را تشکیل میدهد، به دست آورد.[۱۲۸] گاز کلر را میتوان به صورت تجاری از محلولهای حاوی سدیم کلرید و منیزیم کلرید به دست آورد.[۱۲۹] آهن و آلومینیوم از دیگر عناصری هستند که از دیرباز با استفاده از روشهای الکتروشیمیایی از ترکیبات حاوی آنها جداسازی میشوند.[۱۳۰]
بهعنوان ماده رنگزا

رنگ و جلوه بصری یک از ویژگیهای منحصر به فرد ترکیبات معدنی از جمله ترکیبات یونی است که از دیرباز توسط بشر شناخته شدهاند. این ویژگی میتواند به دلیل وجود یک یون رنگزا یا وجود ناخالصی در ماده یا وجود نوعی نقص ساختاری در ساختار بلوری ماده باشد. این عوامل باعث میشوند تا الکترونها از سطحی از انرژی به سطحی دیگر منتقل شوند که این فرایند با آزاد شدن انرژی به صورت موج الکترومغناطیسی همراه است و توسط چشم انسان به رنگهای مختلف دیده میشود.[۱۳۱] بهطور تجربی مشخص شدهاست که ترکیبات یونی حاوی فلزات واسطه، تمایل بیشتری به ایجاد ترکیبات رنگی متنوع دارند.[۱۳۲]
امروزه، در صنعت رنگرزی و رنگسازی از مواد رنگزای مختلفی استفاده میشود که برخی از آنها ساختار آلی داشته و برخی نیز منشأ معدنی دارند. برخی از این مواد رنگزای یونی که بر اساس رنگ دستهبندی میشوند، عبارتند از:[۱۳۳]
- سفید: تیتانیوم دیاکسید، سرب کربنات، سرب(II) سولفات، روی اکسید، روی سولفید[۱۳۴]
- طیف سرخ تا سرخ قهوهای: آهن اکسید، سرنج یا سرب قرمز، رنگدانههای کادمیوم[۱۳۵]
- زرد: آهن اکسید، سرب(II) کرومات، روی کرومات، بیسموت وانادات[۱۳۶]
- آبی: سنگ لاجورد که خود ترکیبی از چندین ترکیب یونی میباشد.[۱۳۷]
باتری و تولید الکتریسیته
یکی از تواناییهای منحصربهفرد ترکیبات یونی ایجاد محلول الکترولیت در صورت انحلال در آب است که این زمینه را برای کاربرد وسیع در صنایع ساخت باتری و سلولهای الکتریکی فراهم میسازد. نخستین باتری الکتریکی امروزی توسط دانشمند ایتالیایی آلساندرو ولتا و با استفاده از صفحات فلز روی و مس تولید شد. در این باتری با اکسایش فلز روی و احیای فلز مس، یک جریان الکتریکی تولید میشد.[۱۳۸] امروزه، طیف وسیعی از باتریها برای کاربردهای ویژه ساخته میشوند. برخی مانند باطریهای یونلیتیم یا باتریهای نیکل–کادمیم از یک واکنش برگشتپذیر تولید الکتریسته میکنند؛ در نتیجه، باطریهای قابل شارژ هستند. در نقطه مقابل باتریهای قلیایی بر اساس یک واکنش برگشت ناپذیر عمل میکنند؛ در نتیجه، یک بار مصرف هستند.[۱۳۹]
کاربرد خوراکی و دارویی
ترکیبات یونی به لحاظ تأثیر بر بدن انسانها طیف گستردهای از اثرات را دارند. خوردن مقادیر اندکی از ترکیباتی چون KCN، HgO یا AlP میتواند بسیار مهلک و مرگآور باشد. در نقطه مقابل، ترکیبی چون نمک طعام از دیرباز یکی از طعمدهندههای شناختهشده و پرکاربرد از این ترکیبات در زندگی روزمره بشر بودهاست.[۱۴۰] جوش شیرین و بیکینگ پودر که حاوی ترکیبات یونی چون NaHCO۳ هستند، در پخت نان و شیرینی به عنوان عامل ورآورنده کاربرد دارند.[۱۴۱] در صنایع غذایی مونوسدیم گلوتامات به عنوان معطرکننده و تحریککننده، کلسیم فسفاتها به عنوان ضد کپک[۱۴۲] و سدیم نیتریت نیز در ساخت فرآوردههای گوشتی چون سوسیس و کالباس به عنوان نگه دارنده کاربرد دارند.[۱۴۳]
بسیاری دیگر از ترکیبات یونی به عنوان مکمل خوراکی به صورت کپسول و قرص برای تأمین ریزمغذیهای مورد نیاز بدن کاربرد دارند. علاوه بر این، در علم فارماکولوژی نیز برای بهبود در فرایند دارورسانی از تکنیکهایی استفاده میشود که طی آن ترکیبات دارویی نامحلول در آب، با واکنش با برخی اسیدها به نمکهای محلول در آب تبدیل میشوند. نمونهای از این فرایند هیدروکلرید کردن ترکیبات دارویی آمینی یا آمیدی مانند متفورمین یا بوپروپیون است. در طی این فرایند، HCl به نیتروژن آمینی یک +H داده و آن را تبدیل به یک کاتیون میکند. HCl نیز به آنیون −Cl تبدیل میشود؛ در نتیجه، نمکی از ماده موثره دارویی و کلرید حاصل میشود. عمده نمکهای دارویی به شکل کلرید هستند (۱۵٫۵٪) اما شکلهای دیگر نمکهای دارویی نیز وجود دارند که حاوی یونهایی چون سدیم (۹٪)، سولفات (۴٪)، استات (۲٫۵٪)، فسفات (۱٫۹٪) و… هستند. بیش از ۵۰٪ مولکولهای دارویی موجود در بازار بهصورت نمک عرضه میشوند. شکل نمک دارو عمدتاً تأثیری بر اثرات دارویی ماده موثره ندارد و تنها باعث افزایش انحلالپذیری دارو و بهبود در فرایند دارورسانی میشود.[۱۴۴][۱۴۵][۱۴۶][۱۴۷]
جستارهای وابسته
یادداشتها
- ↑ ion
- ↑ Hard acid/base
- ↑ Soft acid/base
- ↑ Alum
- ↑ Prussian blue
- ↑ Berlin blue
- ↑ Parisian blue
- ↑ Binary
- ↑ باید در این روش توجه داشت که پسوند به نام لاتین عنصر اضافه میشود؛ در نتیجه، اسامی فارسی و حتی انگلیسی در این روش قابل استفاده نیستند؛ مثلاً Fe در لاتین با نام "ferr" شناخته میشود و نامهای «آهن» یا "Iron" قابل استفاده نیست.
- ↑ Polyatomic Ions
- ↑ در زبان انگلیسی ous به ite و ic به ate تبدیل میشود.
- ↑ برای اتمهای فلوئور، برم و ید نیز به ترتیب هیپوفلوریت، هیپوبرمیت و هیپویدیت خواهد بود.
- ↑ برای اتمهای فلوئور، برم و ید نیز به ترتیب فلوریت، برمیت و یدیت خواهد بود.
- ↑ برای اتمهای فلوئور، برم و ید نیز به ترتیب فلورات، برمات و یدات خواهد بود.
- ↑ برای اتمهای فلوئور، برم و ید نیز به ترتیب پرفلورات، پربرمات و پریدات خواهد بود.
- ↑ Single replacement reactions
- ↑ double replacement reaction
- ↑ Precipitation reactions
- ↑ James Cloyd Downs
پانویس
- ↑ “William Bragg's spectrometer”.
- ↑ “ion”.
- ↑ “Michael Faraday (1791-1867)”.
- ↑ Stern, “Goddard Space Flight Center”.
- ↑ Bragg and Bragg, “The Reflection of X-rays by Crystals”.
- ↑ Bragg, “The reflection of X-rays by crystals. (II.)”.
- ↑ Sherman, “Crystal Energies of Ionic Compounds and Thermochemical Applications”.
- ↑ Sherman, “Crystal Energies of Ionic Compounds and Thermochemical Applications”.
- ↑ Brindley and James, “A quantitative study of the reflexion of X-rays by sylvin.”.
- ↑ Sherman, “Crystal Energies of Ionic Compounds and Thermochemical Applications”.
- ↑ Tarr، Fischer و Miessler، Inorganic Chemistry، 226.
- ↑ Hustrulid, “Ore”.
- ↑ Rutledge, “Ore”.
- ↑ شارپ، فرهنگ شیمی، 449.
- ↑ “Description of the Atmosphere”.
- ↑ Gammon and Ebbing, “General Chemistry”, 270-271.
- ↑ Gammon and Ebbing, “General Chemistry”, 270.
- ↑ شارپ، فرهنگ شیمی، ۷۰۳–۷۰۴.
- ↑ Gammon and Ebbing, “General Chemistry”, 270-271.
- ↑ شارپ، فرهنگ شیمی، ۵۴۳.
- ↑ Gammon and Ebbing, “General Chemistry”, 272.
- ↑ Tarr، Fischer و Miessler، Inorganic Chemistry، 226.
- ↑ Yoder, “Ionic Compounds: Applications of Chemistry to Mineralogy”, 19-22.
- ↑ Tarr، Fischer و Miessler، Inorganic Chemistry، 201-205.
- ↑ Silberberg، Principles of General Chemistry، 283.
- ↑ Gammon and Ebbing, “General Chemistry”, 272.
- ↑ Pauling، The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry، 507.
- ↑ Kittel، Introduction to solid state physics، 64.
- ↑ Pauling، The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry، 509.
- ↑ Carter, “Lattice Energy”.
- ↑ Silberberg، Principles of General Chemistry، 281-282.
- ↑ Silberberg، Principles of General Chemistry، 374.
- ↑ “Crystal system”.
- ↑ Borchardt-Ott, “Crystallography”, 293-300.
- ↑ شارپ، فرهنگ شیمی، ۶۷۷.
- ↑ McGraw-Hill, “McGraw-Hill Concise Encyclopedia of Chemistry”, 517-518.
- ↑ شارپ، فرهنگ شیمی، 33.
- ↑ McGraw-Hill, “McGraw-Hill Concise Encyclopedia of Chemistry”, 27.
- ↑ “Alum”.
- ↑ شارپ، فرهنگ شیمی، 197.
- ↑ “Prussian blue”.
- ↑ شارپ، فرهنگ شیمی، 212.
- ↑ Silberberg, Principles of General Chemistry, 53-54.
- ↑ Connelly, “Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005”, 6,8.
- ↑ Connelly, “Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005”, 72,73.
- ↑ Silberberg، Principles of General Chemistry، 54.
- ↑ Silberberg، Principles of General Chemistry، 55.
- ↑ Silberberg، Principles of General Chemistry، 55.
- ↑ Silberberg، Principles of General Chemistry، 54,55.
- ↑ عابدینی و محمدی بقاعی، شیمی آلی فلزی، ۲.
- ↑ Silberberg، Principles of General Chemistry، 56.
- ↑ عابدینی و محمدی بقاعی، شیمی آلی فلزی، ۲.
- ↑ شارپ، فرهنگ شیمی، 560.
- ↑ Silberberg، Principles of General Chemistry، 56.
- ↑ Connelly، Nomenclature of Inorganic Chemistry: IUPAC، 254,251.
- ↑ Silberberg، Principles of General Chemistry، 56.
- ↑ Ebbing و Gammon، «General Chemistry»، 55.
- ↑ Norman, “Chemical compound”.
- ↑ “Guanidinium”.
- ↑ “Fluoronium”.
- ↑ “Pyrylium”.
- ↑ شارپ، فرهنگ شیمی، 728.
- ↑ “Single replacement reactions”.
- ↑ Silberberg، Principles of General Chemistry، 122-125.
- ↑ McGraw-Hill, “McGraw-Hill Concise Encyclopedia of Chemistry”, 197-201-202.
- ↑ Downs, “U.S. Patent no. 1,501,756”.
- ↑ “Production of Aluminum: The Hall-Héroult Process”.
- ↑ “Ammonium Dichromate Volcano”.
- ↑ Gammon and Ebbing, “General Chemistry”, 128-127.
- ↑ Galwey, “Thermal Decomposition of Ionic Solids”, 345,349,350.
- ↑ Galwey, “Thermal Decomposition of Ionic Solids”, 329.
- ↑ Galwey, “Thermal Decomposition of Ionic Solids”, 370-371.
- ↑ Neugebauer, “The Heat Formation of Ammonium Dichromate”.
- ↑ شارپ، فرهنگ شیمی، ۳۸۷.
- ↑ Yoder, “Ionic Compounds: Applications of Chemistry to Mineralogy”, 155-156.
- ↑ Gammon and Ebbing, “General Chemistry”, 378.
- ↑ Silberberg، Principles of General Chemistry، 116, 117.
- ↑ Gammon and Ebbing, “General Chemistry”, 379-380.
- ↑ Silberberg، Principles of General Chemistry، 737.
- ↑ Yoder, “Ionic Compounds: Applications of Chemistry to Mineralogy”, 135،147،148.
- ↑ Gammon and Ebbing, “General Chemistry”, 558.
- ↑ Gammon and Ebbing, “General Chemistry”, 558.
- ↑ Gammon and Ebbing, “General Chemistry”, 558.
- ↑ Gammon and Ebbing, “General Chemistry”, 559.
- ↑ Silberberg، Principles of General Chemistry، 117, 118.
- ↑ شارپ، فرهنگ شیمی، 276.
- ↑ Silberberg، Principles of General Chemistry، 116, 117.
- ↑ Silberberg، Principles of General Chemistry، 117.
- ↑ Gammon and Ebbing, “General Chemistry”, 411-410.
- ↑ Higdon, “Calcium”.
- ↑ Bettger and Bray, “The physiological role of zinc as an antioxidant”.
- ↑ Bettger and Bray, “The physiological role of zinc as an antioxidant”.
- ↑ Bettger and Bray, “The physiological role of zinc as an antioxidant”.
- ↑ Niemeyer, Mery and Zawar, “Ion channels in health and disease”.
- ↑ Marban, Yamagishi and Tomaselli, “Structure and function of voltage‐gated sodium channels”.
- ↑ Al-Ghamdi, Cameron and Sutton, “Magnesium Deficiency: Pathophysiologic and Clinical Overview”.
- ↑ “Magnesium”.
- ↑ Erikson and Ascher, “Essential Metals in Medicine: Therapeutic Use and Toxicity of Metal Ions in the Clinic”, 253–266.
- ↑ Pecoraro, Caudle and Law, “Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity”.
- ↑ Takeda, “Manganese action in brain function”.
- ↑ Levy and Nassetta, “Neurologic Effects of Manganese in Humans: A Review”.
- ↑ Silva Avila, Luiz Puntel and Aschner, “Interrelations between Essential Metal Ions and Human Diseases”, 199–227.
- ↑ Berend, van Hulsteijn and Gans, “Chloride: The queen of electrolytes?”.
- ↑ Rein and Coca, ““I don’t get no respect”: the role of chloride in acute”.
- ↑ Gupta and Kaur, “Chloride Ion Channels: Structure, Functions, and Blockers”.
- ↑ Gupta and Kaur, “Chloride Ion Channels: Structure, Functions, and Blockers”.
- ↑ “Clinical correlates of pH levels: bicarbonate as a buffer”.
- ↑ Bandino, Compagnone and Battaglia, “Cobalt induces oxidative stress in isolated liver mitochondria responsible for permeability transition and intrinsic apoptosis in hepatocyte primary cultures”.
- ↑ Rebola, Tonazzini and Karovic, “Toxic effects of cobalt in primary cultures of mouse astrocytes: Similarities with hypoxia and role of HIF-1α”.
- ↑ Bandino, Compagnone and Battaglia, “Cobalt induces oxidative stress in isolated liver mitochondria responsible for permeability transition and intrinsic apoptosis in hepatocyte primary cultures”.
- ↑ Rebola, Tonazzini and Karovic, “Toxic effects of cobalt in primary cultures of mouse astrocytes: Similarities with hypoxia and role of HIF-1α”.
- ↑ Levy and Nassetta, “Neurologic Effects of Manganese in Humans: A Review”.
- ↑ Ortega, Bresson and Fraysse, “Cobalt distribution in keratinocyte cells indicates nuclear and perinuclear accumulation and interaction with magnesium and zinc homeostasis”.
- ↑ Levy and Nassetta, “Neurologic Effects of Manganese in Humans: A Review”.
- ↑ Higdon, “Iron”.
- ↑ Higdon, “Iron”.
- ↑ “Iron deficiency – United States, 1999–2000”.
- ↑ Hider and Kong, “Chapter 8. Iron: Effect of Overload and Deficiency”.
- ↑ Dlouhy and Outten, “Chapter 8.4 Iron Uptake, Trafficking and Storage”.
- ↑ Higdon, “Iron”.
- ↑ 2014 et al, “Epidemiological and nonclinical studies investigating effects of iron in carcinogenesis--a critical review”.
- ↑ Powlson et al, “When Does Nitrate Become a Risk for Humans?”.
- ↑ Thompson, “Overview of Nitrate and Nitrite Poisoning”.
- ↑ شارپ، فرهنگ شیمی، 453.
- ↑ Weinert، Oral Hygiene Products.
- ↑ شارپ، فرهنگ شیمی، 128.
- ↑ شارپ، فرهنگ شیمی، 148 و 149.
- ↑ شارپ، فرهنگ شیمی، 476.
- ↑ شارپ، فرهنگ شیمی، 159.
- ↑ شارپ، فرهنگ شیمی، 29 و 415.
- ↑ Yoder, “Ionic Compounds: Applications of Chemistry to Mineralogy”, 135.
- ↑ شارپ، فرهنگ شیمی، ۷۸۰.
- ↑ شارپ، فرهنگ شیمی، ۶۰۳.
- ↑ Buxbaum, “Industrial Inorganic Pigments”, 51.
- ↑ Buxbaum, “Industrial Inorganic Pigments”, 121.
- ↑ Buxbaum, “Industrial Inorganic Pigments”, 123.
- ↑ Buxbaum, “Industrial Inorganic Pigments”, 136.
- ↑ Lefrou، Electrochemistry، 10،11.
- ↑ Lefrou، Electrochemistry، 30.
- ↑ شارپ، فرهنگ شیمی، 703.
- ↑ شارپ، فرهنگ شیمی، 706.
- ↑ شارپ، فرهنگ شیمی، 333.
- ↑ کاتزونگ، فارماکولوژی پایه وبالینی، 270.
- ↑ “Hydrochloride”.
- ↑ Serajuddin, “Salt formation to improve drug solubility”.
- ↑ Anderson, “Drug Names and Their Pharmaceutical Salts - Clearing Up the Confusion”.
- ↑ “What Does HCl Mean on a Prescription Bottle? Understanding Salt Forms of Medication”.
منابع
منابع فارسی
- عابدینی، منصور؛ محمدی بقاعی، داور (۱۳۹۲). شیمی آلی فلزی. تهران: موسسه انتشارات علمی دانشگاه صنعتی شریف. شابک ۹۷۸-۹۶۴-۲۰۸-۰۷۶-۲.
- شارپ، دیوید ویلیام آرتور (۱۳۹۴). فرهنگ شیمی. ترجمهٔ عیسی یاوری. تهران: نوپردازان. شابک ۹۷۸-۹۶۴-۹۷۵-۲۴۰-۲.
- کاتزونگ، برترام جی. (۱۳۹۸). فارماکولوژی پایه وبالینی. ج. ۱. ترجمهٔ مجید متقینژاد. تهران: اندیشه رفیع. شابک ۹۷۸-۹۶۴-۹۸۷-۸۰۲-۷.
منابع انگلیسی
- Ebbing, Darrell; Gammon, Steven D. (2015). General Chemistry (به انگلیسی). United States of America: Cengage Learning.
- Miessler, Gary L.; Fischer, Paul J.; Tarr, Donald A. (2014). Inorganic Chemistry (به انگلیسی). United States of America: Pearson.
- McGraw-Hill (2004). McGraw-Hill Concise Encyclopedia of Chemistry (به انگلیسی). United States of America: McGraw-Hill.
- Silberberg, Martin S (2012). Principles of General Chemistry (به انگلیسی) (3 ed.). United States of America: McGraw-Hill.
- Connelly, Neil G, ed. (2005). Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005 (به انگلیسی). Norfolk, UK: Royal Society of Chemistry.
- Galwey, A.K.; Brown, M.E. (1999). Thermal Decomposition of Ionic Solids. Studies in Physical and Theoretical Chemistry (به انگلیسی). Vol. 86. Netherlands: Elsevier Science.
- Yoder, Claude H. (2006). Ionic Compounds: Applications of Chemistry to Mineralogy (به انگلیسی). Hoboken, New Jersey: Wiley-Interscience.
- Buxbaum, Gunter (2005). Industrial Inorganic Pigments (به انگلیسی). Germany: Wiley-Interscience.
- Borchardt-Ott, Walter (2012). Crystallography (به انگلیسی) (3 ed.). Springer-Verlag Berlin Heidelberg. doi:10.1007/978-3-642-16452-1.
- Pauling, Linus (1960). The nature of the chemical bond and the structure of molecules and crystals: an introduction to modern structural chemistry (به انگلیسی) (3rd ed.). Ithaca, N.Y.: Cornell University Press. ISBN 978-0-8014-0333-0.
- Kittel, Charles (2005). Introduction to solid state physics (به انگلیسی) (8th ed.). Hoboken, NJ: John Wiley & Sons. ISBN 978-0-471-41526-8.
- Lefrou, Christine; Fabry, Pierre; Poignet, Jean-Claude (2012). Electrochemistry (به انگلیسی). Springer-Verlag Berlin Heidelberg.
- Erikson, Keith M.; Ascher, Michael (2019). Essential Metals in Medicine: Therapeutic Use and Toxicity of Metal Ions in the Clinic (به انگلیسی). Vol. 19. Berlin: de Gruyter GmbH. doi:10.1515/9783110527872. PMID 30855111.
- Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). "Chapter 7. Manganese in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences (به انگلیسی). Vol. 13. Springer. doi:10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMID 24470093.
- Gupta, Satya P.; Kaur, Preet K. (2011). Gupta, Satya Prakash (ed.). Chloride Ion Channels: Structure, Functions, and Blockers. Ion Channels and Their Inhibitors (به انگلیسی). Springer Berlin Heidelberg. pp. 309–339. doi:10.1007/978-3-642-19922-6_11. ISBN 9783642199226.
- Hider, Robert C.; Kong, Xiaole (2013). "Chapter 8. Iron: Effect of Overload and Deficiency". In Astrid Sigel, Helmut Sigel and Roland K.O. Sigel (ed.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences (به انگلیسی). Vol. 13. Springer. pp. 229–94. doi:10.1007/978-94-007-7500-8_8. PMID 24470094.
- Dlouhy, Adrienne C.; Outten, Caryn E. (2013). "Chapter 8.4 Iron Uptake, Trafficking and Storage". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Science (به انگلیسی). Vol. 12. Springer. doi:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. PMC 3924584. PMID 23595675.
مقالهها
- Bray, Tammy M.; Bettger, William J. (1990). "The physiological role of zinc as an antioxidant". Free Radical Biology and Medicine (به انگلیسی). 8 (3): 281–291. doi:10.1016/0891-5849(90)90076-U. PMID 2187766. Retrieved 17 November 2020.
- Bragg, William Henry; Bragg, William Lawrence (1913). "The Reflection of X-rays by Crystals". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences (به انگلیسی). 88 (605): 428–438. doi:10.1098/rspa.1913.0040. Retrieved 24 April 2020.
- Bragg, William Henry (1913). "The reflection of X-rays by crystals. (II.)". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences (به انگلیسی). 89 (610): 246–248. doi:10.1098/rspa.1913.0082. Retrieved 24 April 2020.
- Sherman, Jack (August 1932). "Crystal Energies of Ionic Compounds and Thermochemical Applications". Chemical Reviews (به انگلیسی). 11 (1): 93–170. doi:10.1021/cr60038a002. Retrieved 24 April 2020.
- James, Reginald William; Brindley, G. W. (1928). "A quantitative study of the reflexion of X-rays by sylvine". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences (به انگلیسی). 121 (787): 155–171. Bibcode:1928RSPSA.121..155J. doi:10.1098/rspa.1928.0188. Retrieved 24 April 2020.
- Neugebauer, C. A.; Margrave, J. L. (1957). "The Heat Formation of Ammonium Dichromate". The Journal of Physical Chemistry A (به انگلیسی). 10 (61). doi:10.1021/j150556a040. Retrieved 19 August 2020.
- Weinert, Wolfgang (2000). "Oral Hygiene Products". Ullmann's Encyclopedia of Industrial Chemistry (به انگلیسی). doi:10.1002/14356007.a18_209. Retrieved 11 September 2020.
- Serajuddin, Abu T M (2007). "Salt formation to improve drug solubility". Advanced Drug Delivery Reviews (به انگلیسی). 59 (7). doi:10.1016/j.addr.2007.05.010. PMID 17619064. Retrieved 26 Nov 2020.
- Battaglia, Valentina; Compagnone, Alessandra; Bandino, Andrea (2009). "Cobalt induces oxidative stress in isolated liver mitochondria responsible for permeability transition and intrinsic apoptosis in hepatocyte primary cultures". The International Journal of Biochemistry & Cell Biology (به انگلیسی). 41 (3): 586–594. doi:10.1016/j.biocel.2008.07.012. Retrieved 28 Nov 2020.
- Karovic, Olga; Tonazzini, Ilaria; Rebola, Nelson (2007). "Toxic effects of cobalt in primary cultures of mouse astrocytes: Similarities with hypoxia and role of HIF-1α". Biochemical Pharmacology (به انگلیسی). 73 (5): 694–708. doi:10.1016/j.bcp.2006.11.008. PMID 17169330. Retrieved 28 Nov 2020.
- Law, Neil A.; Caudle, M. Tyler; Pecoraro, Vincent L. (1998). "Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity". Advances in Inorganic Chemistry (به انگلیسی). 46: 305–440. doi:10.1016/S0898-8838(08)60152-X. ISBN 9780120236466. Retrieved 29 Nov 2020.
- Marban, Eduardo; Yamagishi, Toshio; Tomaselli, Gordon F. (1998). "Structure and function of voltage‐gated sodium channels". The Journal of Physiology (به انگلیسی). 508 (3): 647–657. doi:10.1111/j.1469-7793.1998.647bp.x. ISSN 1469-7793. PMC 2230911. PMID 9518722. Retrieved 29 Nov 2020.
- Niemeyer, Barbara A.; Mery, Laurence; Zawar, Christian (2001). "Ion channels in health and disease". EMBO reports (به انگلیسی). 2 (7): 568–573. doi:10.1093/embo-reports/kve145. ISSN 1469-221X. PMC 1083959. PMID 11463739. Retrieved 29 Nov 2020.
- Takeda, Atsushi (2003). "Manganese action in brain function". Brain Research Reviews (به انگلیسی). 41 (1): 79–87. doi:10.1016/S0165-0173(02)00234-5. PMID 12505649. Retrieved 29 Nov 2020.
- Al-Ghamdi, Saeed M.G.; Cameron, Eugene C.; Sutton, Roger A.L. (1994). "Magnesium Deficiency: Pathophysiologic and Clinical Overview". American Journal of Kidney Diseases (به انگلیسی). 24 (5): 737–752. doi:10.1016/S0272-6386(12)80667-6. PMID 7977315. Retrieved 29 Nov 2020.
- Beguin, Y; Aapro, M; Ludwig, H; Mizzen, L; Osterborg, A (2014). "Epidemiological and nonclinical studies investigating effects of iron in carcinogenesis--a critical review". Critical Reviews in Oncology/Hematology (به انگلیسی). 89 (1): 1–15. doi:10.1016/j.critrevonc.2013.10.008. PMID 24275533.
- Levy, Barry S.; Nassetta, William J. (2003). "Neurologic Effects of Manganese in Humans: A Review". International Journal of Occupational and Environmental Health (به انگلیسی). 9 (2): 153–163. doi:10.1179/oeh.2003.9.2.153. ISSN 1077-3525. PMID 12848244.
- Berend, Kenrick; van Hulsteijn, Leonard Hendrik; Gans, Rijk O.B. (2012). "Chloride: The queen of electrolytes?". European Journal of Internal Medicine (به انگلیسی). 23 (3): 203–211. doi:10.1016/j.ejim.2011.11.013. PMID 22385875.
- Rein, Joshua L.; Coca, Steven G. (2019). ""I don't get no respect": the role of chloride in acute kidney injury". American Journal of Physiology - Renal Physiology (به انگلیسی). 316 (3): F587–F605. doi:10.1152/ajprenal.00130.2018. ISSN 1931-857X. PMC 6459301.
- Powlson, David S.; Addiscott, Tom M.; Benjamin, Nigel; Cassman, Ken G.; De Kok, Theo M.; Van Grinsven, Hans; l'Hirondel, Jean-Louis; Avery, Alex A.; Van Kessel, Chris (2008). "When Does Nitrate Become a Risk for Humans?". Journal of Environmental Quality (به انگلیسی). 37 (2): 291–5. doi:10.2134/jeq2007.0177. PMID 18268290.
- Ortega, Richard; Bresson, Carole; Fraysse, Aurélien (2009). "Cobalt distribution in keratinocyte cells indicates nuclear and perinuclear accumulation and interaction with magnesium and zinc homeostasis". Toxicology Letters (به انگلیسی). 188 (1): 26–32. doi:10.1016/j.toxlet.2009.02.024. ISSN 0378-4274. PMID 19433266. Retrieved 30 Nov 2020.
- Centers for Disease Control and Prevention (2002). "Iron deficiency – United States, 1999–2000". MMWR (به انگلیسی). 51 (40): 897–899. PMID 12418542.
وبسایتها و منابع برخط
- Carter, Robert (2015). "Lattice Energy" (PDF) (به انگلیسی). Archived from the original (PDF) on 2016-01-19. Retrieved 17 November 2020.
- "William Bragg's spectrometer" (به انگلیسی). Royal Institution of Great Britain. Archived from the original on 12 Feb 2019. Retrieved 8 April 2020.
- "Ammonium Dichromate Volcano" (به انگلیسی). University of Minnesota. 2020. Archived from the original on 10 April 2020. Retrieved 10 April 2020.
- Norman, Richard O.C. (2020). "Chemical compound" (به انگلیسی). Encyclopædia Britannica. Archived from the original on 15 May 2019. Retrieved 11 April 2020.
- "Guanidinium" (به انگلیسی). PubChem. 2020. Archived from the original on 14 April 2020. Retrieved 14 April 2020.
- "Fluoronium" (به انگلیسی). ChemSpider. 2020. Archived from the original on 22 September 2019. Retrieved 14 April 2020.
- "pyrylium" (به انگلیسی). PubChem. 2020. Archived from the original on 24 Mar 2016. Retrieved 14 April 2020.
- "Alum" (به انگلیسی). Encyclopædia Britannica. 2020. Archived from the original on 7 April 2020. Retrieved 17 April 2020.
- "Prussian blue" (به انگلیسی). American Chemical Society. 23 January 2017. Archived from the original on 29 January 2019. Retrieved 19 April 2020.
- Stern, David P. (2008). "Positive Ions--History" (به انگلیسی). Goddard Space Flight Center. Archived from the original on 15 Jan 2017. Retrieved 23 April 2020.
- "Michael Faraday (1791-1867)" (به انگلیسی). BBC. 2016. Archived from the original on 25 Aug 2016. Retrieved 23 April 2020.
- "ion" (به انگلیسی). Online Etymology Dictionary. 2011. Archived from the original on 14 May 2011. Retrieved 23 April 2020.
- Hustrulid, William Andrew (2017). "Ore" (به انگلیسی). Encyclopædia Britannica. Archived from the original on 31 Mar 2018. Retrieved 24 April 2020.
- Rutledge, Kim (2011). "Ore" (به انگلیسی). National Geographic. Archived from the original on 3 Feb 2017. Retrieved 24 April 2020.
- "Description of the Atmosphere" (به انگلیسی). Department of Earth & Climate Sciences San Francisco State Universitys. 2019. Archived from the original on 20 April 2020. Retrieved 24 April 2020.
- "Single replacement reactions". Khan Academy (به انگلیسی). Khan Academy. 2016. Archived from the original on 10 July 2016. Retrieved 20 August 2020.
- "Production of Aluminum: The Hall-Héroult Process". Production of Aluminum: The Hall-Héroult Process (به انگلیسی). American Chemical Society. 1997. Archived from the original on 5 August 2013. Retrieved 28 August 2020.
- "Crystal system" (به انگلیسی). Encyclopædia Britannica. 2015. Archived from the original on 20 Sep 2015. Retrieved August 29, 2020.
- "Hydrochloride" (به انگلیسی). UCLA Department of Chemistry & Biochemistry. 2019. Archived from the original on 16 Jan 2020. Retrieved 26 Nov 2020.
- Anderson, Leigh Ann (2020). "Drug Names and Their Pharmaceutical Salts - Clearing Up the Confusion". Drugs.com (به انگلیسی). Archived from the original on 20 Feb 2020.
- "What Does HCl Mean on a Prescription Bottle? Understanding Salt Forms of Medication" (به انگلیسی). Pharmacist By Your Side. 2019. Archived from the original on 11 Nov 2020.
- Downs, James Cloyd (1924). "U.S. Patent no. 1,501,756" (به انگلیسی). United States Patent and Trademark Office. Archived from the original on 28 Jun 2020. Retrieved 28 Nov 2020.
- "Clinical correlates of pH levels: bicarbonate as a buffer" (به انگلیسی). The University of Arizona. 2006. Archived from the original on 31 May 2015. Retrieved 28 Nov 2020.
- Higdon, Jane (2001). "Calcium" (به انگلیسی). Linus Pauling Institute. Archived from the original on 19 Jun 2020. Retrieved 29 Nov 2020.
- "Magnesium" (به انگلیسی). National Institutes of Health. 2020. Archived from the original on 27 Sep 2020. Retrieved 29 Nov 2020.
- Higdon, Jane (2001). "Iron" (به انگلیسی). Linus Pauling Institute. Archived from the original on 26 Nov 2020. Retrieved 30 Nov 2020.
- Thompson, Larry J. (2014). "Overview of Nitrate and Nitrite Poisoning" (به انگلیسی). Merck & Co., Inc. Archived from the original on 29 Sep 2020. Retrieved 30 Nov 2020.









![سلول دانز که برای تولید فلز سدیم با استفاده از مذاب سدیم کلرید استفاده میشود. این روش نخستین بار توسط شیمیدان آمریکایی جیمز کلوید داونز[ط] ابداع شد.[۶۶]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6a/DownsCellSchematicColor.png/200px-DownsCellSchematicColor.png)
![فرایند هال–هرولت فرایندی صنعتی جهت تولید انبوه فلز آلومینیم به روش برقکافت است. این روش نخستین بار توسط دو دانشمند به نامهای چارلز مارتین هال و پائول هرولت در سال ۱۸۸۶ میلادی ابداع گردید.[۶۷]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/24/Hall-heroult-kk-2008-12-31.png/200px-Hall-heroult-kk-2008-12-31.png)

